01
企业申报开始
昨日(9月27日)起,按照湖北省发布的《中成药省际联盟集中带量采购公告(第1号)》,所有相关企业需自主进行产品清单申报,有效申报时间为9月27日9时至10月8日17时。
文件要求,产品清单应包含采购目录内本企业所有符合申报资格的产品(具体到药品名称、剂型、规格、最小包装数量、包装材质、药品企业),企业应如实填报供应联盟地区每个产品未来一年的最大产能,如预计该产品不再生产,则填“0”。
预计国庆假期结束,申报工作截止后,该项目将正式进入后续资审、评审等阶段。
据梳理,湖北中成药省际采购联盟纳入了湖北、河北、山西、内蒙古、辽宁、福建、江西、河南、湖南、海南、重庆、四川、贵州、西藏、陕西、甘肃、宁夏、新疆、新疆生产建设兵团19个省份,相较此前的流传文件,青海退出,重庆加入。
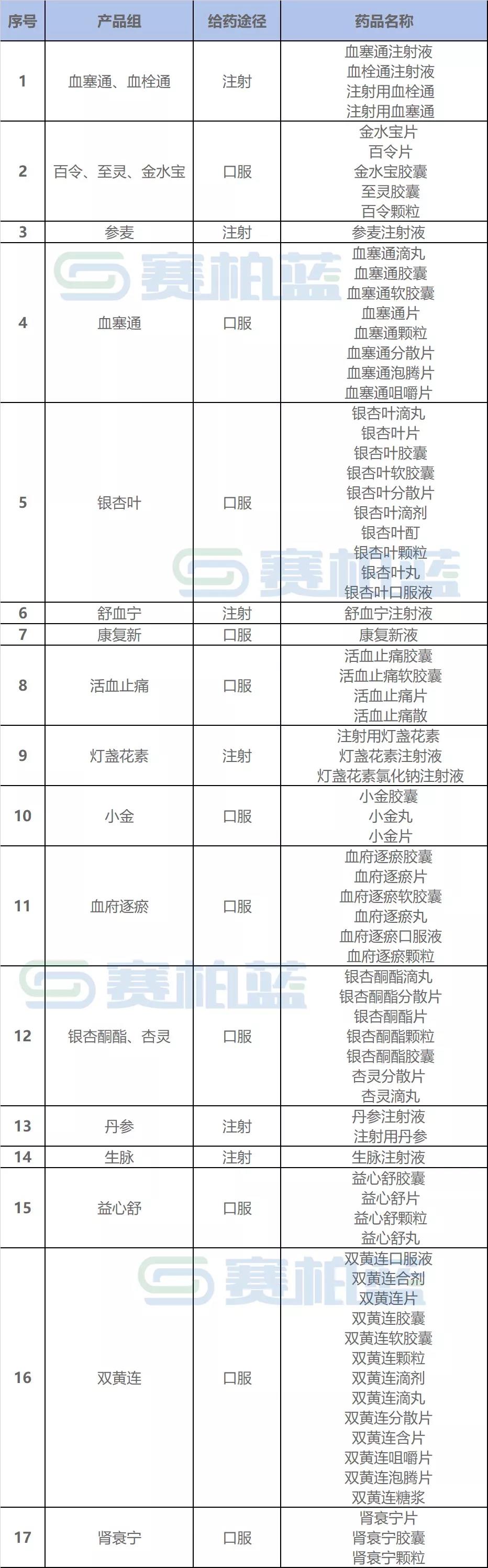
采购品种方面,选择临床使用量大、采购金额高、多家企业生产的76个中成药品,根据产品的功能主治、给药途径和成分,将此次采购药品划分为17个产品组进行集采。较流传文件增加了血塞通咀嚼片、银杏叶口服液2个品种,由74个,变为76个。
9月14日,广东牵头7省组成联盟也对58个通用名的中成药开展带量采购,两大联盟参与省份多有重合:山西、河南、海南、宁夏、新疆。也就是说,除广东和青海外,广东7省联盟其余省份均同时参加了两大中成药采购联盟。
由于采购品种选定原则较为相似,因此两大联盟采购品种也多有重合。湖北19省联盟集采合计76个产品合并为17组,广东7省联盟合计140个产品合并为27组,血塞通、血栓通、舒血宁、康复新等品种在两个采购榜单中都有出现。
两采购联盟成员、产品重合度较高,文件发布时间也相差不大,因此相关省份、品种最后的采购方案还有待官方做出进一步的说明。
02
这些品种较安全
9月25日,赛柏蓝于北京举办2021中药大品种打造与市场营销策略研讨会。会上,知名医药营销专家孙跃武表示:目前来看,含道地药材的药品、国家中药保护品种、国家保密处方、国家级创新奖项、5年内新上市品种、以及通过了三万例以上的上市后安全性集中临床验证的药品被纳入中成药带量采购的可能性较小。
可以看出,上述药品基本都是国家政策引导下,发展受到保护支持的品种。
道地药材:
中药材的生产多带有一定的地域特色,其产地与其产量、质量皆有着密切关系。一般来说,道地药材和普通药材相比质量较高,我国也非常重视对道地药材的扶持保护。
《中华人民共和国中医药法》提出,要建立道地中药材评价体系,支持道地中药材品种选育;扶持道地中药材生产基地建设;保护道地中药材。
道地药材质量较高,价格也更高。含道地药材的药品成本自然也更高,考虑到这一因素,相关品种纳入集采可能性较小。
保护品种:
中药保护品种是国家为了提高中药品种的质量,保护中药生产企业的权益,促进中药事业的发展,制定的专利保护条例。据了解,受保护的中药品种分为一、二级,一级的保护期限为三十年、二十年、十年不等,二级的保护期限为七年。
《中药品种保护条例》规定,符合下列条件之一的中药品种,可以申请一级保护:对特定疾病有特殊疗效的;相当于国家一级保护野生药材物种的人工制成品;用于预防和治疗特殊疾病的。
而符合下列条件之一的中药品种,可以申请二级保护:符合一级保护条件的品种或者已经解除一级保护的品种;对特定疾病有显著疗效的;从天然药物中提取的有效物质及特殊制剂。
赛柏蓝查询国家药监局官网发现,目前已有131个产品被纳入中药保护品种。
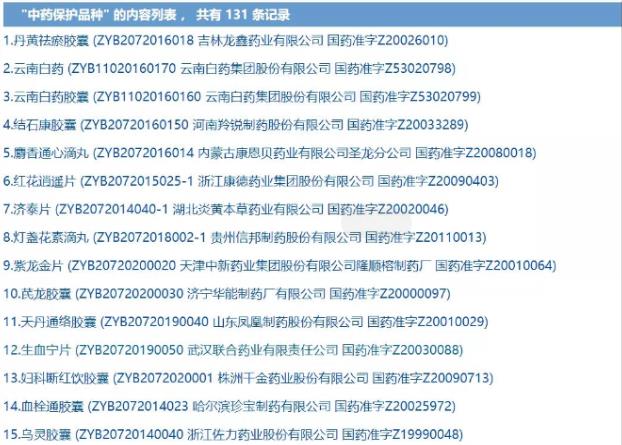
图片来源:国家药监局官网
国家保密配方和国家保护品种的性质相似,分两个等级。前者为国家绝密级的配方,保密期限为永久,目前只有两个,分别是云南白药和漳州片仔癀。
后者为国家级保密配方,当前有五个,分别为:北京同仁堂的安宫牛黄丸、广州奇星药业的华佗再造丸、杭州雷允上的六神丸、上海和黄药业的麝香保心丸、山西广誉远国药的龟龄集,保密期限为长期。
创新药:
中药企业在研发创新方面的投入相对化药企业来说较少,受到研发周期较长,受政策影响较大、发展方向不明确等因素的影响,中药企业的研发积极性较弱。
不过近年来国家为鼓励中药创新已经制定了不少相关政策。
2019年,《药品注册管理办法征求意见稿》发布,提出了药品注册管理的基本要求,并明确将以符合中药特点对中药注册管理另文要求。
2020年,国家药品监督管理局发布了《关于真实世界证据支持药物研发与审评的指导原则的通告》,这是国内首个关于真实世界证据支持药物研发与审评的指导文 件。
长期以来如何证明中药的有效性是制约中药临床发展的核心难题,而真实世界研究较为契合中医个性化诊疗和整体疗效评价特点,对中药上市后再评价和中药新药的研发都有较大帮助。
2021年9月,国家药监局批准了两款中药新药上市,分别为天津东方华康医药科技发展有限公司的益气通窍丸和石家庄以岭药业的益肾养心安神片。在国家政策的引导下,相信未来还将有更多的中药新药上市。
上市后再评价:
一直以来部分中成药的临床安全性和有效性存在一定争议。进行药品上市后再评价可以用更有说服力的证据来支撑中成药的临床作用,中成药才能具备好的临床价值,进而创造好的市场价值。
国务院早在2016年印发的《中医药发展战略规划纲要(2016-2030年)》也强调了上市后再评价的作用,提出为全面提升中药产业发展水平,要开展中成药上市后再评价,加大中成药二次开发力度,开展大规模、规范化临床试验。
目前,国家药品带量采购已经进行了五批,平均降幅达50%以上。带量采购之下,大批仿制药企业的利润被压缩,一部分企业将工作重心转移到了随着国家利好政策支持,发展的越来越好的创新药中。
注重药材质量,加大创新力度无疑是国家倡导的中医药未来发展方向,而对于中药企业来说,想要获得长久的发展,顺应政策的引导是不可回避的方向。
附:湖北中成药集采联盟采购名单: